Grundlagen der Gaschromatographie
![]() Geschichte
der LowCost - Gaschromatographie
Geschichte
der LowCost - Gaschromatographie
Bei
der Gaschromatographie handelt es sich um ein Verfahren, welches zur Trennung
von Stoffgemischen angewandt wird, die gasförmig vorliegen oder vollständig verdampft
werden können.
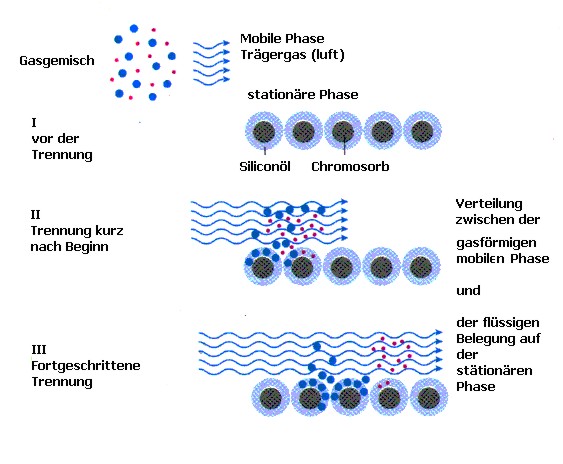
Phasen
Es gibt eine sogenannte "mobile Phase", ein Gas welches durch die
"stationären Phase" strömt. Hierbei handelt e sich z.B. um Paraffine,
Siliconöle und Polymere, die auf einen Träger z.B. Kieselgel aufgebracht sind, und sich
in einer bis zu 2 m langen Metall- oder Glasröhre (Trennsäule) befinden. Je nach
Polarität des zu trennenden Stoffgemisches wählt man nun eine geeignete
"stationäre Phase", so dass die einzelnen Komponenten des Stoffgemisches
unterschiedlich stark an der "stationären Phase " adsorbiert oder zwischen den
Phasen verteilt werden, und somit ihre Verweilzeiten in der Trennsäule möglichst
verschieden sind.
Injektion
Aufgebracht wird das Stoffgemisch mit einer Injektionsspitze am Beginn der Säule.
Wenn nun eine der Komponenten des Stoffgemisches, die mit der "stationären
Phase" gefüllte Säule (im temperierbaren Raum), durchlaufen hat, trifft sie auf
einen Detektor.
Detektion
Bei der Detektion der Substanzen nutzt man z. B. ihr unterschiedliches
Wärmeleitfähigkeitsvermögen gegenüber dem Trägergas aus. Das Gas strömt an einer
elektrisch beheizten glühenden Wendel vorbei. Sind nun im Gemisch Teilchen mit einer
großen Wärmeleitfähigkeit vorhanden, so kühlen sie die Wendel stärker ab als das
Trägergas. Die Folge ist eine größere Stromstärke. Diese Änderung hat nun zur Folge,
dass nach elektrischer Verstärkung auf dem ebenfalls angeschlossenen Schreiber ein
sogenannter "Peak" entsteht. Die Methode heißt Wärmeleitfähigkeitsdetektion
(WLD).
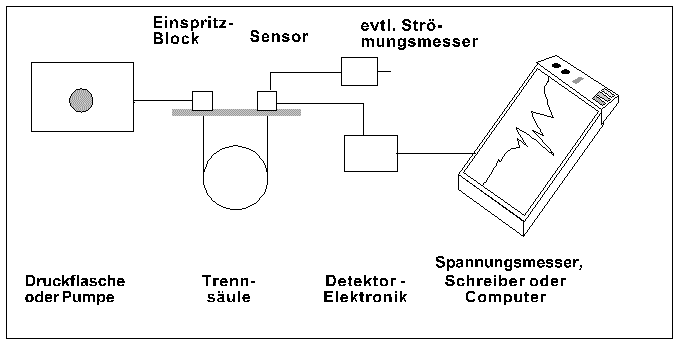
In gewissen Grenzen lässt sich das Trennergebnis durch den Gasdruck, den man evtl. am
Reduzierventil ablesen kann, bzw. durch die Gasmenge, die man mit dem Strömungsmesser
messen kann, beeinflussen. Zur Vergleichbarkeit der Chromatogramme sind diese Werte sowie
Trägermaterial und Temperatur im Chromatogramm zu vermerken.
In der Abbildung sind die wichtigsten Funktionseinheiten eines Gaschromatographen dargestellt:
Eine Adsorption erfolgt fast immer dann, wenn Gase oder Lösungen mit einer festen Phase in Wechselwirkung treten. Beispiel: Versetzt man z.B. Rotwein mit Aktivkohle und schüttelt gut durch, so erhält man nach dem Filtrieren eine wasserklare Flüssigkeit. Die Farbstoffe und Aromastoffe des Rotweins werden an der Aktivkohle adsorbiert. Beispiele für gute Adsorbentien sind: Aktivkohle, Kieselgel, Aluminiumoxid, Stärke und Cellulose.
Die Adsorption ist um so stärker (intensiver), je größer die Oberfläche des Adsorbens ist. Ursache der Adsorptionsvorgänge sind Wechselwirkungen zwischen dem Adsorbens und dem adsorbierten Stoff. Im Inneren eines homogenen Stoffes sind Atome, Moleküle oder Ionen von gleichartigen Teilchen umgeben, so dass nach allen Seiten hin gleich große Kräfte wirken. Bei den Teilchen an der Oberfläche sind ihre Bindungskräfte nach außen hin nicht abgesättigt. Sie sind daher in der Lage, andere Moleküle oder Ionen zu binden. Adsorptionsvorgänge beruhen im wesentlichen auf VAN - DER - WAALS - Bindungen. Sie verlaufen exotherm, so dass die Adsorption mit steigender Temperatur abnimmt.
Trennung durch Adsorption - Ein märchenhaftes Prinzip:
Weit von hier regierte einst ein mächtiger König. Natürlich hatte er eine schöne Tochter. Und er wollte sie ausgerechnet dem stärksten und kräftigsten Mann seines Reiches zur Frau geben. Aber den musste er erst einmal finden.
Da rief er alle Weisen seines Reiches zu sich und fragte sie um guten Rat. Der war teuer - die Herren litten an Kreativitätsmangel. Bis auf einen - Chromos genannt. Der hatte eine pfiffige Idee: " Majestät", sagte er, "im Westen Eures Reiches fließt ein reißender Fluss. Nutzt ihn für einen Super-Wettbewerb. Lasst Eure Ingenieure in regelmäßigen Abständen Pfähle über dem Fluss befestigen - gerade so hoch und so dick, daß ein schwimmender Mensch sie ergreifen kann. Wenn Ihr nun einen Mann in den Fluss werft, kann er einen Pfahl fassen und sich daran festhalten - bis die Strömung ihn wieder mit sich fortreißt. Sie wird ihn zur nächsten Pfahl tragen, und er wird sich auch daran festhalten. Je stärker der Mann ist, desto öfter und desto länger wird es ihm gelingen, sich festzuhalten. Wenn Ihr nur genug Pfähle zwischen Start und Ziel befestigt habt, wird unweigerlich der schwächste Mann zuerst und der stärkste zuletzt am Ziel eintreffen. Das wird ein spannendes Rennen für Eure Untertanen."
Der König, für neue sportliche Ideen stets aufgeschlossen, ließ die Rennstrecke bauen. Nicht der Schnellste sollte siegen, sondern der Langsamste. Und so geschah es. Einfach, schonend und ohne Blutvergießen wurde der Sieger ermittelt und mit der Königstochter vermählt.

Die Sportwissenschaftler aber nannten den Fluss mobile Phase, die Pfähle stationäre Phase und die Zeit, die ein Athlet für die Strecke benötigte, Retentionszeit. Denn Retention heißt soviel wie Festhalten oder Zurückhalten. Und zu Ehren des weisen Königsberaters nannten sie den neuen Sport "Chromatographie". Und weil diese Begriffe so schön wissenschaftlich klangen, wurden eines Tages auch die Naturwissenschaftler auf die märchenhaften Möglichkeiten des neuen Sports aufmerksam. Sie schickten nicht Bewerber um die Hände von Königstöchtern, sondern chemische Substanzen auf die Strecke. Statt eines reißenden Flusses wählten sie als mobile Phase ein Lösungsmittel. Die Pfähle wurden durch absorbierende Stoffe wie Kieselgel oder Aluminiumoxid ersetzt. Und wie man sieht, chromatographieren sie noch heute.
Schüttelt man eine wässrige Iodlösung mit dem gleichen Volumen an Tetrachlormethan, so wird der größte Teil des Iods von der organischen Phase aufgenommen. Es stellt sich bei konstanter Temperatur ein Verteilungsgleichgewicht des Iods zwischen den beiden nicht mischbaren flüssigen Phasen ein. Das Verhältnis der Stoffmengenkonzentration in den beiden Phasen ergibt den Verteilungskoeffizienten K.
| Verteilungsgesetz nach Nernst: K = | Konzentration in Phase 1 |
| Konzentration in Phase 2 |
Bei der Verteilung eines Stoffes zwischen zwei Phasen nimmt das Verhältnis seiner Stoffmengenkonzentration bei konstanter Temperatur einen konstanten Wert an. Dieses Verteilungsgesetz gilt nur für den Fall, dass der gelöste Stoff in beiden Phasen in der gleichen Form (Aggregatzustand) vorliegt. Er darf nicht dissoziieren, dimerisieren oder Addukte mit dem Lösungsmittel bilden.
In der Praxis ist das Ausschütteln oder die diskontinuierliche Extraktion organischer Verbindungen der wichtigste Mechanismus. Die Lösung eines Stoffgemisches wird in einen Scheidetrichter gegeben und mit einer nicht mischbaren Flüssigkeit versetzt. In dem zugesetzten Lösungsmittel sollte sich der abzutrennende Stoff gut lösen.
Rechnerische Simulation zur Verteilung -
Lösungsblatt
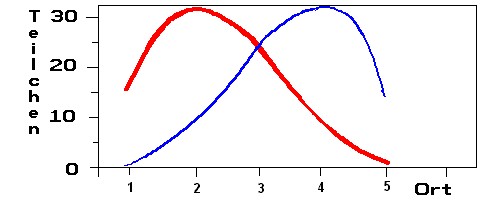
Die Trennung zweier Komponenten durch Verteilung in verschiedenen Zeitabschnitten soll hier verdeutlicht werden. Die oberen Kästchen sollen jeweils die mobile Phase (MP), die unteren die stationäre (SP) darstellen. Die Stoffe sollen sich nach einem festen Zahlenverhältnis auf die Phasen verteilen:
| Komponente 1 | Komponente 2 | |
| mobile Phase | 1 | 2 |
| Stationäre Phase | 2 | 1 |
Die roten Teilchen verteilen sich um Verhältnis 1 /2 auf die mobile und stationäre Phase, die blauen Teilchen 2/1.
Benutzen Sie bitte für die Bearbeitung zwei Stifte mit unterschiedlichen Farben! Schreiben Sie die Teilchenzahl von Stoff 1 mit der ersten Farbe immer links in das Kästchen, die Teilchenzahl von Stoff 2 mit der zweiten Farbe immer rechts in das Kästchen!
1. Zunächst sind jeweils 81 Teilchen von jeder Sorte in die oberen Phase (Ort 1, oberstes Kästchen) "eingefüllt" (links 81 und rechts 81 hingeschrieben).
- In Schritt 2 verteilt sich Stoff 1 am Ort 1 auf beide Phasen bis sich das Gleichgewicht 2:1 eingestellt hat (links oben: 54, unten: 27). Der zweite Stoff verteilt sich entsprechend (rechts oben 27, unten 54).
- Die mobile Phase schiebt die oberen Teilchen von Ort 1 nach Ort 2 (links oben 54 und rechts oben 27) - unten bleibt noch frei. An Ort 1 verbleiben unten links 27 und rechts 54 (oben: frei).
- Dann werden die Teilchen am Ort (oben und unten) aufsummiert und neu verteilt und so weiter....
Zeichnen Sie zum Schluss die Summe der Teilchen am jeweiligen Ort (übereinander stehende Kästchen) mit den jeweiligen Farben in das Koordinatensystem ein!
| 1. Einfüllen der | MP | 81 81 |
||||||
| Teilchen | SP | |||||||
| Ort 1 | Ort 2 | Ort 3 | Ort 4 | Ort 5 | Ort 6 |
| 2. Verteilungs- | MP | ¯ |
27 54 |
|||||
| gleichgewicht | SP | |
54 27 |
| 3. Schieben der | MP | -> | -> -> |
27 54 |
-> -> | |||
| mobilen Phase | SP | 54 27 |
| 4. Verteilungs- | MP | ¯ |
18 18 | 09 36 | ||||
| gleichgewicht | SP | |
36 09 | 18 18 |
| 5. Schieben der | MP | -> | -> -> |
18 18 | 09 36 | -> -> | ||
| mobilen Phase | SP | 36 09 | 18 18 |
| 6. Verteilungs- | MP | ¯ |
12 06 | 12 24 | 03 24 | |||
| gleichgewicht | SP | |
24 03 | 24 12 | 06 12 |
| 7. Schieben der | MP | -> | -> -> |
12 06 | 12 24 | 03 24 | -> -> | |
| mobilen Phase | SP | 24 03 | 24 12 | 06 12 |
| 8. Verteilungs- | MP | ¯ |
08 02 | 12 12 | 06 24 | 01 16 | ||
| gleichgewicht | SP | |
16 01 | 24 06 | 12 12 | 02 08 |
| 9. Schieben der | MP | -> | -> -> |
08 02 | 12 12 | 06 24 | 01 16 | -> -> |
| mobilen Phase | SP | 16 01 | 24 06 | 12 12 | 02 08 |
| Summe der Teilchen | 16 01 | 32 08 | 24 24 | 08 32 | 01 16 | |
| am Ort Nr. | Ort 1 | Ort 2 | Ort 3 | Ort 4 | Ort 5 | Ort 6 |