 L01 L01
Experiment
| Organische Chemie: Qualitative Organische Elementaranalyse

Im allgemeinen wird eine einfache Prüfung auf Kohlenstoff, Wasserstoff und Stickstoff, seltener auf Halogene, Schwefel, Phosphor oder andere Elemente durchgeführt. |  |
|
 L01a L01a
Experiment
| Einfache Qualitative Organische Elementaranalyse (Brenngase - nur: C und H)

Im allgemeinen wird eine einfache Prüfung auf Kohlenstoff, Wasserstoff durchgeführt. |  |
|
 L01b L01b
Experiment
| Einfache Qualitative Organische Elementaranalyse (Alkohol - nur: C und H)

Im allgemeinen wird eine einfache Prüfung auf Kohlenstoff, Wasserstoff durchgeführt. |  |
|
 L02 L02
Experiment
| Quantitative organische Elementaranalyse nach Liebig

Die Elementaranalyse ist ein Verfahren zur Bestimmung der quantitativen Zusammensetzung eines Stoffes. | 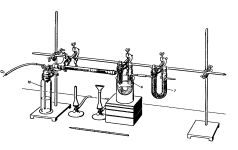 |
|
 L03 L03
Experiment
| Vereinfachte Quantitative Elementaranalyse nach Rinschen

Die Liebig- Analyse wird so vereinfacht, daß nur das Reaktionsprodukt Wasser aufgefangen wird. Falls die Substanz nur C, H und O enthält, wird der Anteil an C ebenfalls berechnet | 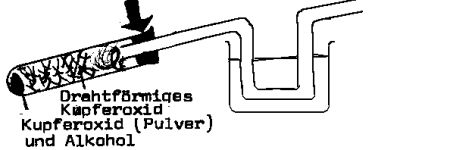 |
|
 L04 L04
Experiment
| Vereinfachte Quantitative Elementaranalyse (nur Kohlenstoff)

Die Substanz wird mit festem Kupferoxid oxidiert. Man geht bei der Reaktion davon aus, daß als einziger gasförmiger Stoff Kohlenstoffdioxid entsteht. Das entstehende Wasser kondensiert. Die Volumina der festen und flüssigen Stoffe (kondensiertes Wasser) werden vernachlässigt | 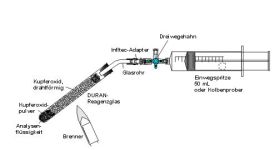 |
|
 L05 L05
Experiment
| Quantitative Halogenanalyse nach Schöninger

Die chlorhaltige Substanz wird verbrannt, wobei Chlorwasserstoff entsteht. Da Chlorwasserstoff sich leicht in Wasser löst, kann man die entstehenden Chloridionen durch Titration mit Silber- Ionen bestimmen. | 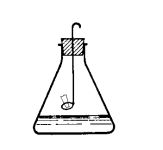 |
|
 L06 L06
Experiment
| Quantitative Kohlenstoffanalyse bei Gasen, die kein N und S enthalten

Die Substanz wird mit festem Kupferoxid oxidiert. Man geht bei der Reaktion davon aus, daß als einziger gasförmiger Stoff Kohlenstoffdioxid entsteht. Aus jedem Kohlenstoffatom entsteht ein Kohlendioxidmolekül. Nach Avogadro bleibt damit das Volumen konstant (C=1) oder es kommt zu einer ganzzahligen Vervielfachung des Ausgangsvolumens. So müssen zum Beispiel aus 1 mol Propan 3 mol Kohlendioxid entstehen. | 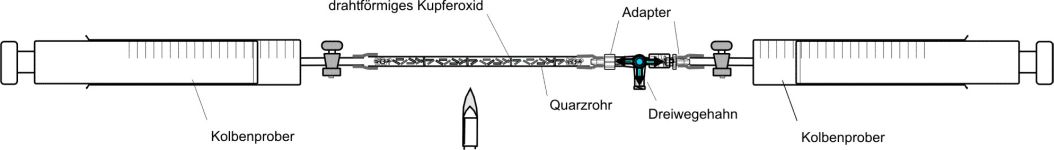 |
|
 L06a L06a
Experiment
| Anzahl der "H"-Atome bei Kohlenwasserstoffen

Bei geschickter Versuchsführung kann man durch Zersetzen eines Kohlenwassertsoffs an Aktivkohle den Wasserstoff fast quantitativ abspalten. Der Verlauf der Reaktion kann mit der Gaschromatographie verfolgt werden. | 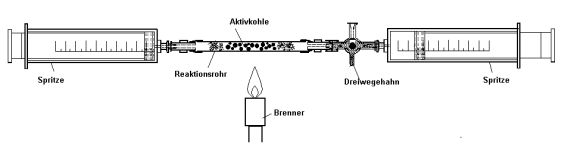 |
|
 L07 L07
Experiment
| Bestimmung der Molmasse von leicht verdampfbaren Flüssigkeiten (Schüttel-Meyer)

Diese "Methode" ist geeignet für flüchtige Stoffe mit einem Siedepunkt bis etwa 75 °C. Ein bestimmtes Volumen einer Flüssigkeit mit bekannter Dichte wird in einem Kolben durch Schütteln verdampft, um in den Geltungsbereich des Gesetzes von Avogadro zu kommen. | 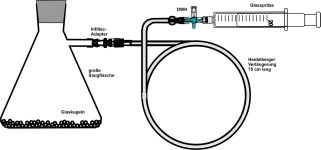 |
|
 L07a L07a
Experiment
| Bestimmung der Molmasse von leicht verdampfbaren Flüssigkeiten (Schüttel-Meyer)

Diese "Methode" ist geeignet für flüchtige Stoffe mit einem Siedepunkt bis etwa 75 °C. Ein bestimmtes Volumen einer Flüssigkeit mit bekannter Dichte wird in einem Kolben durch Schütteln verdampft, um in den Geltungsbereich des Gesetzes von Avogadro zu kommen. | 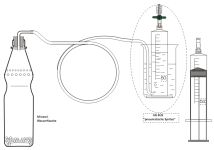 |
|
 L08 L08
Experiment
| Bestimmung der Molmasse (Heizofenmethode)

Die Methode ist geeignet für flüchtige Stoffe mit einem Siedepunkt bis etwa 250 °C. Man gibt ein bestimmtes Volumen einer Flüssigkeit mit bekannter Dichte in einen Kolben und verdampft die Flüssigkeit, um in den Geltungsbereich des Gesetzes von Avogadro zu kommen. | 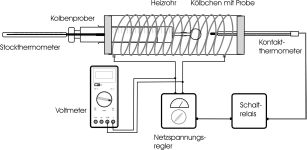 |
|
 L09 L09
Experiment
| Bestimmung der Siedetemperatur

Im Experiment stellt man die Siedetemperatur meist durch Destillation fest, bei der man das Siedeintervall der Substanz feststellt. Die Literaturwerte der Siedetemperatur einer Substanz sind häufig verschieden, weil die Versuche leicht ungenau werden . | |
|
 L10 L10
Experiment
| Bestimmung der Schmelztemperatur

In der Praxis wird bei einfachen Bestimmungen meist das Schmelzintervall aufgenommen und die Schmelztemperatur nach mehreren Versuchswiederholungen ermittelt . | 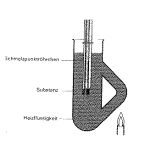 |
|
 L11 L11
Experiment
| Bestimmung der Dichte

Der Quotient aus Masse und Volumen eines Stoffes ist als Dichte definiert. Die Dichte dient als Kriterium für die Reinheit eines Stoffes. | 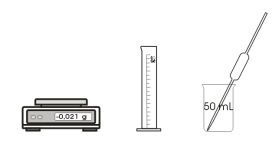 |
|
 L12 L12
Experiment
| Bestimmung des Brechungsindexes (Refraktometrie)

In der Refraktrometrie benutzt man den Brechungsindex (n) um flüssige Substanzen zu identifizieren oder um deren Reinheit zu prüfen. Der Brechungsindex ist stark temperaturabhängig und durch verschiedene Wellenlängen des Lichtes veränderbar. Aus diesem Grund werden die Temperatur und die Wellenlängen als Indizes am Brechungsindex vermerkt z.B. n20d (20 Grad und die D-Linie, 589 nm). | 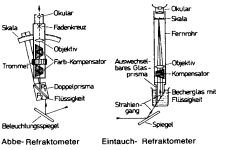 |
|
 L13 L13
Experiment
| Polarimetrie

Es gibt Verbindungen, in denen die Moleküle asymmetrisch gebaut sind. Diese Verbindungen sind "optisch aktiv", d.h., daß sie die Schwingungsebene von linear polarisiertem Licht um einen Drehwinkel (a) drehen können, wenn sie von diesem Licht durchstrahlt werden. Diese Drehung der Polarisationsebene kann nach rechts (+) und auch nach links (-) erfolgen. Die Konzentration c (g/ 100mL Lsg.), die Temperatur, die Schichtdicke l (dm) und die Wellenlänge (l) beeinflussen die Drehung | |
|
Treffer: 17
 Zurück zur Übersicht Zurück zur Übersicht |

























