Getestete Unterrichtsreihe:
Wir untersuchen Marmorkies
(Technischer
Kalkkreislauf)
Vorbemerkung:
11.
Nachweis von Kohlenstoffdioxid
Vorbemerkung:
Der hier skizzierte Unterrichtsgang ist angelehnt an das sehr aufwendig gestaltete Unterrichtswerk von Johann Weninger, Helga Pfundt, Werner Dierks und Wolfgang Marcus, IPN-Lehrgang, "Stoffe und Stoffumbildungen"1. Teil: Ein Weg zur Atomhypothese, welches im Klett-Verlag (1979) erschienen war. (Klettbuch 78121, 78122, 78123 und 78129)
Der Weg wurde modifiziert und in vielen Jahren in NRW mit Erfolg
beschritten. Platziert war er zu Beginn der Klasse 7.
Da an nicht allen Schulen in den verschiedenen Bundesländern die
gleichen Voraussetzungen bzw. Hauscurricula vorhanden sind, um genau den
gleichen Weg zu gehen, muss eventuell die eine oder andere Passage
(s.u.) abgeändert werden.
Als zusätzliche Hilfe zu dem didaktischen Vorschlag finden sich auf der
rechten Seite der Darstellung Links zu Hilfen wie Filmen oder
Arbeitsblättern.
Aus einem Schülerheft
(etwas überarbeitet)
Im
ersten Jahr Chemie sollen wir eine Ahnung bekommen, wie
Naturwissenschaftler arbeiten. Dabei sollen wir nicht nur Stoffe, ihre
Eigenschaften und Naturgesetze kennen lernen, sondern auch wie
Experimente geplant durchgeführt und ausgewertet werden.
Wir
konnten uns den Stoff, den wir als ersten untersuchen sollten, nicht
wählen, sondern der Lehrer stellte einen Sack mit "Marmorkies" aus dem
Baumarkt auf den Tisch und gab jedem eine "Kugel".
Nach der Einführung in die Sicherheitsrichtlinien war die Hausaufgabe
"Seht mal zu, was ihr zu Hause mit dem Marmorkies alles anfangen könnt!"
|
1. Eigenschaften von Marmorkies (MK)
Was wir zu Hause mit dem Marmorkies angestellt haben:
1. Unter der Lupe:
Der MK ist weiß bis grau und ist mit weißem Staub überzogen.
Dies kommt wahrscheinlich daher, dass sich die Stücke aneinander
abreiben. Die Oberfläche hat stecknadelgroße Löcher.
2.1 Mit kaltem Wasser:
Legt man MK in
Wasser, geht er unter und verändert seine Farbe. Diese wird
allmählich dunkler. Holt man MK aus dem Wasser hellt sich die
Farbe über Nacht wieder auf.
2.2 In heißem Wasser:
Man beobachtet das Gleiche wie bei 2.1.
3. Mit einer Feile: MK
ist schleifbar.
4. Mit einem Hammer: MK
ist hart, schlägt man mit dem Hammer darauf, zerspringt er, Man
sieht kleine weiß-grau glitzernde Flächen
5. Streichholz - Kerzenflamme: MK
brennt nicht. Einige Stellen sind schwarz gefärbt. |
AK
Material
|
|
Zum Erhitzen kommen noch verschiedene Beiträge. Der Lehrer
möchte, dass wir die Geschichte mit dem Erhitzen gründlicher
untersuchen. Dazu besprechen wir als erstes
Aufbau und Bedienung des
Gasbrenners - Viele nennen ihn fälschlicherweise
"Bunsenbrenner".
|
|
|
Kennenlernen der chemischen Arbeitsgeräte:
AK Riddle
Wir haben eine Vertretungsstunde in Chemie. Der Lehrer holt uns
in den Chemieraum und wir müssen die Laptops aufbauen. Nach
einer langen Wartezeit können wir endlich starten: Wir müssen
aus vorgegeben Antworten die richtige zur Abbildung eines
Gerätes anklicken. Dafür gibt es Punkte der Punktestand der fünf
besten wird eingeblendet.
Es macht einen Riesenspaß.
Der Lehrer sagt uns, das wir "AK-Riddle" als Bestandteil von
AK WinChemie aus dem
Internet herunter laden können. Die Seite ist: |
Dann aber geht es richtig los. Wir "dürfen" unser erstes Protokoll
schreiben!! Es soll demnächst immer so ähnlich aussehen:
2. Ist MK brennbar? Was geschieht mit dem Stein beim Erhitzen?
|
Prinzip: |
Wir halten MK in eine "saubere", heiße Flamme, um zu sehen, was
passiert. |
|
Skizze: |
entfällt |
|
Material: |
Schutzbrille, Bunsenbrenner, Feuerzeug, Tiegelzange,
Porzellanschale |
|
Chemikalien:
|
MK |
|
Durchführung
Beobachtung: |
Wir halten MK mit Hilfe der Tiegelzange in die „rauschende
Flamme“.
MK fängt an einer Stelle an rötlich zu glühen. Wenn man den MK
lange genug ruhig hält, glüht er sogar gelb.
Nach dem Abkühlen in der Porzellanschale bröckelte er an der
Stelle ab, die erhitzt wurde.
|
|
Ergebnis: |
MK verändert beim starken Erhitzen seine Konsistenz. |
Einige von uns meinen, dass der Stein beim Erhitzen leichter wird. Wir
stimmen ab:
20 sind dafür, dass
er leichter wird
7 sind
dafür, dass er schwerer wird
5
behaupten, dass die Masse sich nicht ändert (Da bin ich dabei.)
Wir wollen diese Vermutung genauer untersuchen.
3. Ändert sich die Masse von MK beim Erhitzen?
|
Prinzip: |
Wir wiegen MK vor und nach dem Erhitzen. |
|
Skizze: |
entfällt |
|
Material: |
Wie bei Versuch 2; zusätzlich: Elektronische Waage
|
|
Chemikalien:
|
MK |
|
Durchführung
Beobachtung: |
Nach dem Abkühlen wiegen wir MK erneut in der
Porzellanschale und notieren wieder die Masse
Masse des Steines + Schale vorher Masse des Steines + Schale vorher
:
.....
... g
Masse des Steines + Schale nachher:
.....
... g
Differenz:
.. ...
... g |
|
Ergebnis: |
MK wird
beim
Erhitzen leichter. |
Nun stellt sich natürlich die Frage: Wo ist das, was beim Erhitzen
verschwindet?
4. Welcher Stoff entsteht beim Erhitzen von MK?
Dann hat Ludger
die Idee:
Wir packen MK in ein Rohr und machen oben einen Luftballon darauf. Der
Lehrer ist begeistert, sagt aber: „Evtl. hält der Ballon die Hitze nicht
aus. Wir nehmen lieber ein Gerät aus der Medizintechnik, das so ähnlich
funktioniert: eine Spritze.“
|
|
 AB: A05A |
| Ergebnis: | Beim Erhitzen vom MK entsteht kein Wasser sondern ein farbloses Gas.
Wir nennen es MK-Gas. |
Nun
haben wir schon zwei Stoffe, die wir untersuchen müssen, das Gas und der
erhitzte MK. Wir fangen mit dem Gas an.
5. Welche Eigenschaften hat MK-Gas?
a) Ist MK-Gas brennbar?
Eigentlich dürfte es nicht brennbar sein, weil wir beim Erhitzen von MK keine
Veränderung der Flamme festgestellt haben. Aber Ludger darf für seine
gute Idee das Gas aus der Spritze über eine Brenndüse in die Bunsenbrennerflamme pusten: Es passiert nichts.
Ergebnis:
MK-Gas ist nicht brennbar.
|
Skizze: |
|
|
Durchführung
Beobachtung: |
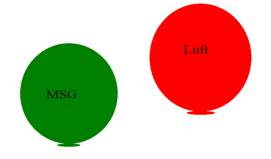
Wir füllen zwei gleiche Luftballons etwa gleichgroß mit Luft bzw. mit
MK-Gas. Maria steigt auf die Bank, hält in jeder Hand einen Ballon. |
|
Ergebnis: |
MK-Gas
ist spezifisch schwerer als Luft.
Der Lehrer möchte aber
die Formulierung haben:
MK-Gas hat eine größere Dichte als Luft. |
Wir wollen wissen, wie das ganz genau ist (mit Zahlen ausgedrückt!).
Deshalb machen wir den Versuch nochmal aber wieder mit Spritze statt
Luftballon.
|
Bestimmung der Dichten von MK-Gas und Luft
|
 Film: A08 |
Ergebnis:
Dichte von
MK-Gas: 1,82 g/L
(bei Raumbedingungen!)
Dichte von Luft:
1,19 g/L
Der Lehrer sagt: Die Dichten sind in den Lexika meist für 0°C angegeben. Da Gase beim Abkühlen eine größere Dichte haben, müssen wir die Werte umrechnen: Wert x 298 K/ 273 K.
Dichte von Luft:
1,19 g/L x 298 K/ 273 K
= 1,30 g/L
Hausaufgabe: Es soll im Internet oder im Lexikon ein Gas gesucht werden,
das in etwa so eine Dichte hat, wie unser MK-Gas.
In der nächsten Stunde kommen die Lösungen:
Ergebnis:
Höchstwahrscheinlich ist MK-Gas Kohlenstoffdioxid.
Es gibt aber eine schöne Begriffsverwirrung. Viele bezeichnen das Gas
als "Kohlensäure", eine Mitschülerin hat sogar gefunden: "Anhydrid der
Kohlensäure". Am einfachsten finden wir noch den Namen "Kohlendioxid".
Unser Lehrer sagt, dass es Normen gibt, die helfen sollen, die Begriffe
zu vereinheitlichen, aber selbst auf der Gasflasche in der
Kohlenstoffdioxid drin sein soll, steht "Kohlensäure" eingeprägt. Wir
benutzen in Zukunft:
Kohlenstoffdioxid
Der Lehrer zeigt uns nochmal, dass Kohlenstoffdioxid spezifisch schwerer
ist als Luft:
|
Er füllt ein großes Aquarium mit Kohlenstoffdioxid und bläst vorsichtig
Zigarettenqualm (Rauchen in der Schule verboten!) darüber. Der Qualm legt sich oben über das Kohlenstoffdioxid. Wenn der Lehrer nun das Aquarium an einer Seite kurz anhebt, gibt es einen tollen Effekt: Die Qualmschicht schaukelt so, als wäre eine Flüssigkeit im Aquarium. Auch ein Luftballonschiff schwimmt auf dem Kohlenstoffdioxid. |
.
 |
Dann zeigt uns der Lehrer ein altes Bild der Hundegrotte.
Bild 29: Die Hunde-Grotte auf der Insel Capri (Italien) In dieser Höhle lagert Kohlensäure über dem Boden. Hunde werden durch sie betäubt, aufrecht stehende Menschen aber erreicht das Gas nicht.
|
6. Ist "erhitzter MK" immer noch das Gleiche wie MK?
Um diese Frage zu klären, hat unser Lehrer eine große Porzellanschale
mit MK im großen Brennofen in der Kunst einen Tag erhitzt. Die "Kugeln"
sehen irgendwie sauberer aus und scheinen leichter zu zerbröckeln, wie
wir es in Versuch 2 erlebt haben. Wahrscheinlich ist es ein neuer Stoff,
denn der Lehrer mahnt uns die Schutzbrillen aufzulassen und "das Zeug"
nicht mit den Händen anzufassen. Wieder starten wir mit dem ersten
Versuch: MK und Wasser
6.1 Wie verhalten sich MK und "erhitzter MK" in Wasser
|
Prinzip: |
Wir geben MK und erhitzten MK in ein Glas mit Wasser,
um zu sehen, was passiert. |
|
Skizze: |
entfällt |
|
Material: |
Schutzbrille, 2 Bechergläser, 250 mL, Tiegelzange, Spatel |
|
Chemikalien: |
MK, Wasser |
|
Durchführung |
Wir füllen die beiden Bechergläser etwa zur Hälfte mit Wasser
und geben vorsichtig mit der Tiegelzange in das eine MK und in
das andere den erhitzen MK. Beim MK geschieht eigentlich nichts.
|
|
Ergebnis: |
Erhitzer MK ist ein neuer weißer Feststoff mit neuen
Eigenschaften. Wir nennen ihn
MK-Light |
Wir
wiederholen den Versuch mit weniger Wasser:
|
Löschen:
Reaktion von MK-Light (Branntkalk)
mit Wasser
|
|
 Film: A05B |
|
Ergebnis: |
Aus MK-Light mit Wasser ist ein neuer weißer Feststoff mit neuen
Eigenschaften entstanden. Wir nennen ihn
MK-Zisch. |
7. Wir untersuchen die Schicht, die oben auf dem MK-Zisch-Wasser bildet.
Es ist so komisch, dass es immer eine ganze Zeit dauert, bis sich die
weiße Schicht aus Versuch 6.1 wieder bildet. Sie bildet sich auch, wenn
wir die Mischung filtrieren und ein ganz sauberes klares Filtrat nehmen.
Und ..... sie bildet sich immer oben. Es scheint so als würde sie aus
der Luft gebildet. Nach vielen Überlegungen hat Carsten eine Idee:" Wir
pusten mal MK-Gas oben drauf" Und.... die Schicht bildet sich schneller.
Als er aus Versehen die Düse in das Wasser hält, trübt es sich sofort an
der Stelle. Darauf müssen wir das Ganze natürlich genauer untersuchen:
|
Abbinden:
Reaktion von MK-Zisch (Löschkalk) mit MK-Gas (Kalkgas) |
|
Zusatzversuch:
In zwei große Schalen geben wir
MK-Zisch-Lösung und blasen darauf Kohlenstoffdioxid. Nach einiger Zeit
fischen wir die Schicht oben ab, trocknen sie und wiederholen mit ihr
den Versuch 4: Es entsteht wieder Gas.
|
Ergebnis: |
Aus MK-Zisch mit MK-Gas entsteht ein weißer Feststoff. Diesen
kennen wir schon: Es ist
MK.
Außerdem entsteht Wasser. Der Kreis hat sich geschlossen. |
Der technische Kalkkreislauf
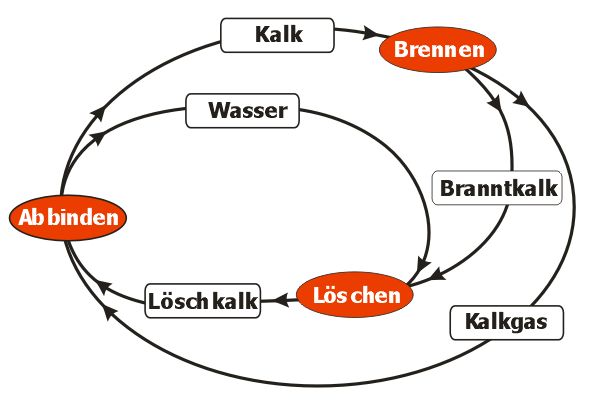
Zusammenfassung:
(in allen möglichen Schreibweisen)
1) Brennen
|
a) Wir |
MK |
|
|
® |
MK-Light |
+ |
MK-Gas |
|
b) Technik |
Kalk |
|
|
® |
Branntkalk |
+ |
Kalkgas |
|
c)
mit LEGO- |
|
|
|
|
|
||
|
d) Formeln |
CaCO3 |
|
|
® |
CaO |
+ |
CO2 |
|
e) Chemie |
Calciumcarbonat |
|
|
® |
Calciumoxid |
+ |
Kohlenstoffdioxid |
2) Löschen
|
a) Wir |
MK-Light |
+ |
Wasser |
® |
MK-Zisch |
|
|
|
b) Technik |
Branntkalk |
+ |
Wasser |
® |
Löschkalk |
|
|
|
c)
mit LEGO- |
|
|
 |
|
|
||
|
c) Formeln |
CaO |
+ |
H2O |
® |
Ca(OH)2 |
|
|
|
d) Chemie |
Calciumoxid |
+ |
Diwasserstoffoxid |
® |
Calciumdihydroxid |
|
|
3) Abbinden
|
a) Wir |
MK-Zisch |
+ |
MK-Gas |
® |
MK |
+ |
Wasser |
|
b) Technik |
Löschkalk |
+ |
Kalkgas |
® |
Kalk |
+ |
Wasser |
|
c)
mit LEGO- |
 |
|
|
|
|||
|
c) Formeln |
Ca(OH)2 |
+ |
CO2 |
® |
CaCO3 |
+ |
H2O |
|
d) Chemie |
Calciumdihydroxid |
+ |
Kohlenstoffdioxid |
® |
Calciumcarbonat |
+ |
Diwasserstoffoxid |
9.
Experiment zur Verfestigung: Wie kann man Calciumdihydroxid, Calciumoxid
und Calciumcarbonat unterscheiden? Alle drei sind weiße Pulver
|
Prinzip |
Durch Zufügen von Wasser und warten, können wir alle drei weißen
Stoffe anhand ihre Reaktionen unterscheiden. |
|
Materialien |
3 Bechergläser, Spatel |
|
Chemikalien |
Pulver1, Pulver2, Pulver3 und Wasser |
|
Skizze |
entfällt |
|
Durchführung |
Wir geben wenig Wasser zu allen drei Proben. Nur bei Probe 1
zischte es, und es wurde warm. Nach einiger Zeit sehen alle drei
Flüssigkeiten "geklärt" aus. Bei den Proben 1 und 2 hat sich
eine weiße Schicht gebildet. Die Proben 1 und 2 sind gleich. |
|
Ergebnis: |
Probe 1 ist Calciumoxid "MK-Light", weil es mit Wasser unter
Zischen reagiert hat.
Probe 2 ist Calciumdihydroxid "MK-Zisch", weil die Probe nach
einiger Zeit genauso aussieht wie Probe 1, die wir in
Calciumdihydroxid-Lösung verwandelt haben.
Probe 3 ist Calciumcarbonat, weil sie nicht so aussieht wie
Probe 1, 2 (und weil nichts anderes mehr übrig bleibt). |
Dann hat uns der Lehrer aufgefordert, etwas zu tun, wozu man den Kalk
wirklich braucht.
Dazu verteilt er uns Unterlagen vom Bayrischen Fernsehen
|
Kalkbrennen im Chiemgau und Der Öko-Maurer aus dem Chiemgau
|
Wir sollten ein Projekt mit Kalk-Mörtel gestalten.
|
Wir bauen Objekte mit Kalkmörtel
Anregungen gibt es jede Menge auf der Homepage http://www.kappenberg.com/hosted/wolbeck/wolb2001-02/photo_haus.htm |
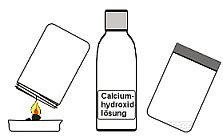
11. Nachweis von Kohlenstoffdioxid
|
Leitet man ein Gas in Calciumdihydroxid-Lösung (MK-Zischlösung) ein und entsteht eine weiße Trübung von Caciumcarbonat (MK), so ist das Gas Kohlenstoffdioxid. |
Insbesondere beim Verbrennen von Benzin, Papier, Holz , Kohle
Feuerzeuggas soll Kohlenstoffdioxid entstehen. Die prüfen wir nach.
|
Nachweis von Kohlenstoffdioxid bei Verbrennungen (nur 2. Teil!)
|
 Film: L01a |
|
Ergebnis: |
Kohlenstoffdioxid enthalten: Benzin-, Papier-, Holz -, Kohleverbrennungsgas und Erdgasverbrennungsgas. Kein Kohlenstoffdioxid ist nachzuweisen bei: Wasserstoff, Wasserstoffverbrennungsgas, Sauerstoff, Stickstoff Helium sowie Erdgas |
Unsere Atmung soll ja auch so eine Art Verbrennung sein. Wir testen dies
mit einer sicheren "Maschine", in der dafür gesorgt ist, dass wir keine
Calciumdihydroxid- Lösung in den Mund bekommen.
|
Nachweis von Kohlenstoffdioxid in der Atemluft
|
 Film: A06 |
|
Ergebnis: |
Ausatemluft enthält Kohlenstoffdioxid. |
12.
Weitere Eigenschaft von Kohlenstoffdioxid: Feuerlöschen
|
Prinzip |
|
|
Materialien |
3 Bechergläser, 800 mL hohe Form |
|
Chemikalien |
2 Teelichte, Kohlenstoffdioxid (Stahlflasche) |
|
Skizze |
entfällt |
|
Durchführung |
Wir geben in zwei Bechergläser je ein angezündetes Teelicht und
füllen das dritte Becherglas mit Kohlenstoffdioxid aus der
Stahlflasche. |
|
Ergebnis: |
Kohlenstoffdioxid löscht die Teelichtflamme. |