F) Praktische Chemie
1. Eigenschaften von Salzen
Elektrische Leitfähigkeit
![]() Wanderung von Ionen im
elektrischen Feld
Wanderung von Ionen im
elektrischen Feld
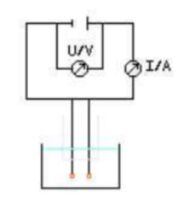
![]() „Schalt“-plan
zur Untersuchung der elektrischen Leitfähigkeit
„Schalt“-plan
zur Untersuchung der elektrischen Leitfähigkeit
Wanderung von Ionen im elektrischen Feld
In einer sehr simplen Apparatur werden unter die Bleche 2
Streifen Indikatorpapier
und ein Streifen zugeschnittenes Filterpapier geklemmt. Dann werden die
Streifen
vorsichtig mit Kaliumnitrat-Lösung getränkt. In der Mitte eines Streifen werden
mit
Salzsäure, Natronlauge und Kaliumpermanganat ganz kleine Pünktchen gemacht und
der Strom angestellt.
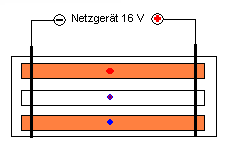
Leider entstehen auch an den Blechen Farben. Aber, wenn man gut beobachtet, wandert
der rote Punkt von der Salzsäure zum "Minus-Pol" - der blaue Punkt
(Natronlauge) und der
blau-violette Punkt (Kaliumpermanganat) zum "Pluspol". Das ist der
Nachweis füre die Ladung
der Ionen H3O+: positiv OH- und MnO4-: negativ. Die positiven Kalium- und die negativen
Nitrat-Ionen kann man nicht sehen.
Eigentlich dürfte Wasser keinen Strom leiten, da es sich um eine
Elektronenpaarbindung mit Ionencharakter
handelt. Also sind im Wasser eigentlich keine Ionen vorhanden.
Wasser ist aber nicht normal, es reagiert mit sich selbst (Autoprotolyse)
|
Wasser |
|
Hydroxid-Ion |
|
Oxonium-Ion |
||
|
H2O + H2O |
|
HO- |
+ |
H3O+ |
Aus diesem Grunde sind im Wasser doch H3O+ und HO- als leitende Ionen vorhanden.
Ihr Anteil beträgt aber nur 1/10000000 mol/l.
„Schalt“-plan zur Untersuchung der elektrischen Leitfähigkeit
Ausgesuchte Leitfähigkeiten
|
Stoff |
L in [mS] |
|
destilliertes Wasser |
1,3 |
|
d. W. + 3 Körnchen NaCl |
4,7 |
|
d. W. + 1 Spatelspitze NaCl |
3930 |
|
Leitungswasser |
0,63 |
|
d. W. + 1 ml NaCl-Lsg. |
1,49 |
|
d. W. + 1 ml MgSO4-Lsg. |
3860 |
|
d. W. + 1 ml Natronlauge verd. |
9770 |
|
d. W. + 1 ml Salzsäure verd. |
13930 |
Die Leitfähigkeit steigt proportional zur Konzentration der Ionen.
Je höher die Ladung eines Ions desto höher die Leitfähigkeit.
OH- Leitet besonders gut und H3O+ noch besser (Leitung über Wasserstoffbrücken).
Elektrolyse von Salzlösungen
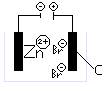
ZnBr2
|
-Pol: |
Zn2+ + |
2e- |
à Zn |
|
+Pol: |
2Br-
- |
2e+ |
à Br2 |
Löst man ZnBr2 in Wasser, schwirren dort Zn2+ und Br- Ionen herum.
Beim Anlegen einer Spannung sieht man am "– Pol" sieht man gräuliches Metall und
am "+ Pol "rotbraunes Brom.
Die Br- Ionen zum +Pol , geben ihr Elektron ab und werden zu Br, welches sofort zu Br2 wird.
Die Zn2+ Ionen wandern zum –Pol, nehmen dort 2 Elektronen auf und werden zu Zn.
Dieser Vorgang läuft nur unter Zufuhr von Energie ab.
Die Zink-Brom-Batterie
Wir modifizieren den Versuch, indem wir anstelle der Stromquelle einen Motor setzen, der auf wundersame Weise anfängt zu laufen. Wir haben einen Batterie geschaffen.
Erklärung:
Zink gibt zwei Elektronen ab und geht als Zn2+ in Lösung.
Br2 nimmt ein Elektron (bzw. je ein) auf und geht als Br- in Lösung.
Die Elektronen wandern vom Zn (-Pol) zum Br (+Pol) durch den Motor und treiben ihn an.
Der Vorgang läuft freiwillig ab, und so lange, bis entweder kein Br oder Zn mehr da ist. Dann ist die Batterie leer. Das Aufladen erfolgt durch Elektrolyse (s.o.). Wir haben einen tollen Akku.