Der glückseligmachende Zustand
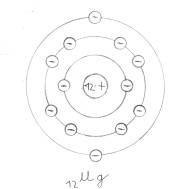
Periodensystem
Das Arbeitsblatt kann man als WORD - Dokument laden:
1. Ionenbindung (Metall und Nichtmetall):
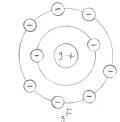
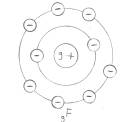
Jedes Element ist bestrebt, acht Elektronen auf seiner äußeren Schale zu besitzen (Ausnahme: 1. Schale: 2 Elektronen). Metalle erreichen dies durch Elektronenabgabe, Nichtmetalle durch Elektronenaufnahme.
Merken:

|
|
|
Elektronenpaarbindung (Nichtmetalle):
Jedes Element ist bestrebt, acht Elektronen auf seiner äußeren Schale zu besitzen (Ausnahme: 1. Schale: 2) . Zwei oder mehr Nichtmetalle erreichen dies durch gemeinsame Nutzung von einzelnen Elektronen als Bindungselektronen.
Verbindung von F mit F
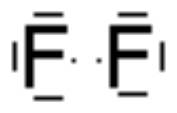
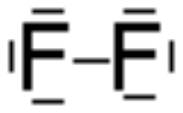
Das Arbeitsblatt kann man als WORD - Dokument laden:
Anwendung:
(Siehe
hierzu Arbeitsblatt AC 04)
Welche Eigenschaften haben folgende Verbindungen?
Magnesium und Chlor
Magnesium = Metall , Chlor=Nichtmetall ---> Ionenbindung
Magnesium gibt zwei Elektronen ab; ein Chlor nimmt nur ein
Elektron auf
Formel: Mg2+ Cl2-
Hierbei handelt es sich um eine Ionenbindung (Salz).
Daraus folgt:
![]() sehr hoher Siede- und Schmelzpunkt
sehr hoher Siede- und Schmelzpunkt
![]() Stromleitung im flüssigen Zustand oder
gelösten Zustand
Stromleitung im flüssigen Zustand oder
gelösten Zustand
![]() hart und spröde
hart und spröde
Chlor und Chlor
Chlor ist ein Nichtmetall ---> eine Elektronenpaarbindung (ähnliche Nichtmetalle).
D EN: 0
Formel: Cl2
Daraus folgt:
![]() sehr niedriger Siede- und Schmelzpunktpunkt
sehr niedriger Siede- und Schmelzpunktpunkt
![]() keine Stromleitung
keine Stromleitung
![]() relativ gut verformbar
relativ gut verformbar
Schwefel und Wasserstoff
Chlor ist ein Nichtmetall, Schwefel ist ein Nichtmetall ---> eine Elektronenpaarbindung mit Ionencharackter
D EN: 0,4
Formel: H2S
![]() niedriger Siedepunkt
niedriger Siedepunkt
aber höher als normal: Dipolkräfte
![]() keine Stromleitung
keine Stromleitung
![]() relativ gut verformbar
relativ gut verformbar
Sauerstoff und Wasserstoff
Sauerstoff ist ein Nichtmetall, Wasserstoff ist ein Nichtmetall ---> eine Elektronenpaarbindung mit Ionencharackter
H2O D EN: 1,4
![]() relative niedriger Siedepunkt
relative niedriger Siedepunkt
aber höher als normal: Dipolkräfte und noch höher als normal: Wasserstoffbrückenbindung
![]() keine Stromleitung (Herr Kappenberg
behauptet es leitet doch)
keine Stromleitung (Herr Kappenberg
behauptet es leitet doch)
![]() etwas verformbar (Gletscher)
etwas verformbar (Gletscher)