SO DEN=1,0
Elektronenpaarbindung mit Ionencharakter
Vorüberlegungen
Welche
Formel ist die Richtige?
Reaktion
von Schwefeldioxid mit Wasser
Ist
die entstandene Säure H2SO3?
VERGLEICH:
Herstellung von Schwefelsäure
im Labor und in der Industrie
Es wird vorgeschlagen, Schwefel zu verbrennen und das Ergebnis mit Wasser reagieren zu lassen.
![]()
SO DEN=1,0
Elektronenpaarbindung mit Ionencharakter
Mögliche weitere Formeln:
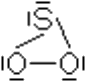
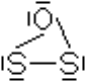
Schwefel verbrennt mit bläulicher Flamme in Sauerstoff und es entsteht dabei ein Gas.
Mögliche Reaktionsgleichungen:
1) 2 S (fest) + 1 O2 (gasförmig) --> 2 SO (gasförmig)
2) 1 S (fest) + 1 O2 (gasförmig) --> 1 SO2 (gasförmig)
3) 4 S (fest) + 1 O2 (gasförmig) --> 2 S2O (gasförmig)
4) 2 S (fest) + 3 O2 (gasförmig) --> 2 SO3 (gasförmig)

Bei Gleichung 1) und 3) verdoppelt sich das Volumen.
Bei Gleichung 4) verringert es sich.
Nur bei Gleichung 2) bleibt es gleich.
Wenn man Schwefel mit Sauerstoff verbrennt, entsteht Schwefeldioxid (SO2).
Wenn Schwefeldioxid mit Wasser reagiert nimmt das Volumen ab und es entsteht ein Unterdruck. Die Flüssigkeit färbt das Indikatorpapier rot - es ist eine Säure entstanden.
Merke:
Säure - Rot
Lauge - Blau
1) 2 SO2 (g) + 1 H2O (fl) [--> H2S2O5
(fl)
[ + Mg --> 1 H2 (g) +
Mg...
2) 1 SO2 (g) + 1 H2O (fl) [--> H2SO3
(fl)
[ + Mg --> 1 H2 (g) +
Mg...
3) 1 SO2 (g) + 2 H2O (fl) [--> H4SO4
(fl)
[ + Mg --> 2 H2 (g) +
Mg...
Von allen diesen Stoffen sind nur 2 gasförmig:
Schwefeldioxid und Wasserstoff.
Bei 1) halbiert sich die Menge des Gases,
bei 2) bleibt sie gleich,
bei 3) halbiert sie sich.
Magnesium setzt etwa die gleiche Menge an Wasserstoff frei, wie sich vorher
SO2 in Wasser gelöst hat.
Formel 2) ist richtig. Es entsteht schweflige Säure.
Das ist Mist (Zitat: Dr. Kappenberg), denn wir wollen H2SO4.
Wenn man zu Schwefelsäure kommen will gibt es mehrere Möglichkeiten ein O "einzubauen"...
|
|
Labor
|
Industrie
|
|
- Ausgangsstoffe |
- Sauerstoff,
Schwefel |
- Sauerstoff,
Schwefel |
|
- 1. Reaktionsstufe |
- Reaktionsrohr |
- Verbrennungsofen |
|
- Abkühlen |
- Glaskugel |
- im Abhitzkessel |
|
- Filtern |
- Glaswolle |
- Elektrofilter |
|
- 1. Ergebnis |
- SO2 |
- SO2 |
|
- 2. Reaktionsstufe |
- Platinkatalysator:
SO2 mit Luft |
- Kontaktofen: SO2
mit Luft |
|
- 2. Ergebnis |
- SO3 |
- SO3 |
|
- Abkühlen |
- Glaskugel |
- Wärmetauscher |
|
- 3. Reaktionsstufe |
- Lösung in
Schwefelsäure in der Gaswaschflasche |
- Absorption im
Absorptionsturm |
|
- 3. Ergebnis |
- H2SO4 |
- H2SO4 |
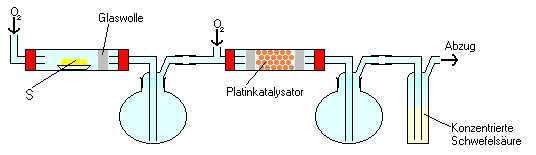
Herstellung von Schwefelsäure im Labor